今卡-生物图像提供:
1. 客观的H&E切片图像分析。
2. 客观的PAS切片图像分析。
3. 客观的免疫荧光图像分析。
4. 多重免疫荧光/空间蛋白组学细胞距离分析。
5. 电泳条带强度值分析。
6. 细菌长度和宽度测量。
7. 胞内亮点测量。
8. 其它未在上述列出的图像相关分析(欢迎联系我们)。
客观的图片分析,能够避免人为主观分析的各种缺点,比如(1)相对随意的图片区域选择;(2)不同分析人员之间的标准差异;(3)同一分析人员不同时间的标准差异等,因此可以保证结果的可重复性。
1. 客观的H&E切片图像自动分析流程
1.1 理论基础
各种原因导致的炎症都伴随白细胞的浸润1,或直观理解为病灶部位细胞增多,其通常通过H&E切片染色进行鉴别2。
本流程通过计数H&E切片中的相对细胞(核)总数和相对细胞核总面积,以实现客观的H&E切片自动分析。
1.2 流程和实例
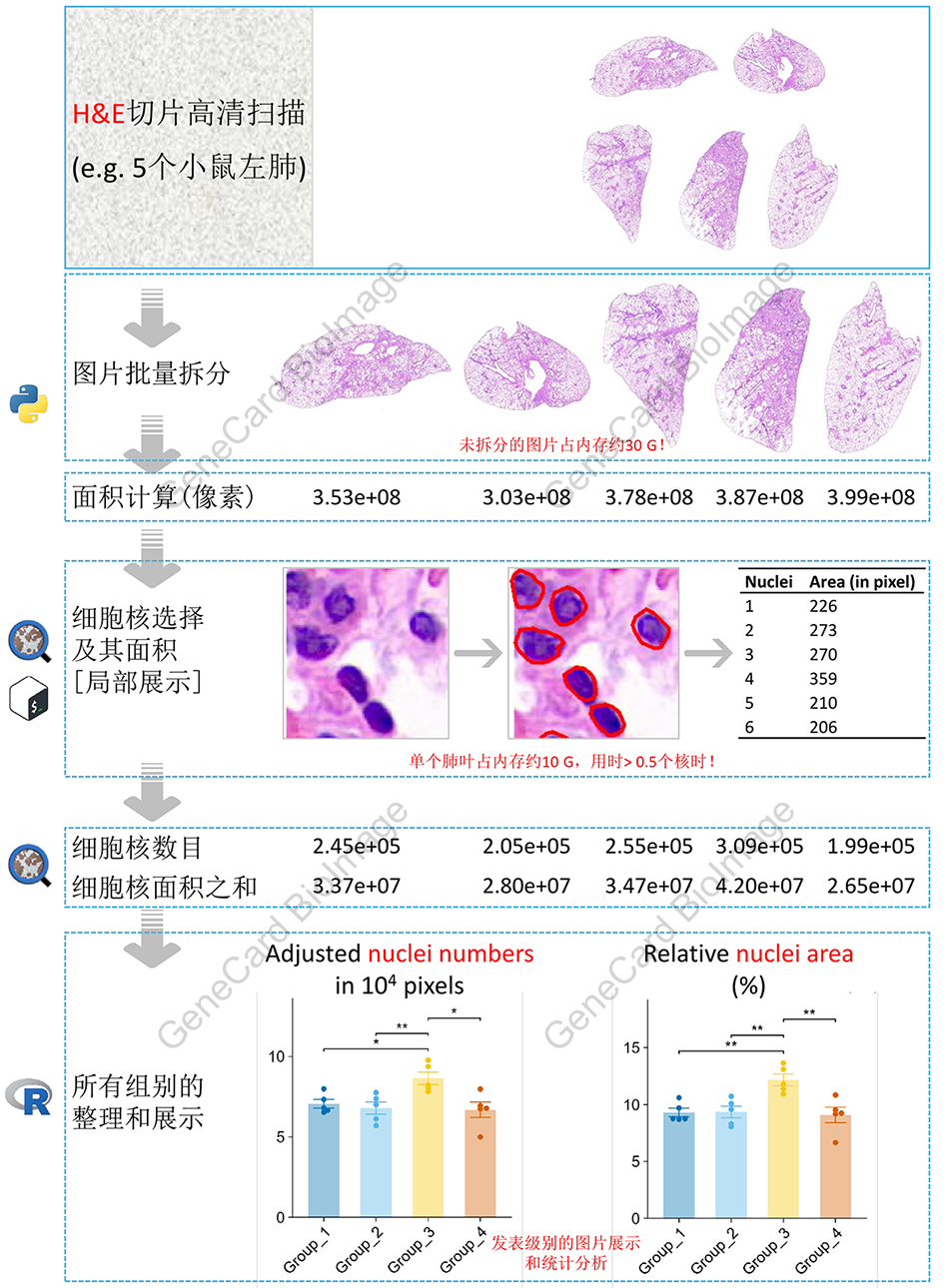
说明:示例所用组织切片使用3DHISTECH公司出品的Pannoramic 250 FLASH数字病理切片扫描仪进行扫描,采用20×明场物镜,获得全幅高分辨率数字图像,并保存为.mrxs格式以供分析。本示例切片的.mrxs格式文件大小约600 M。
2. 客观的PAS切片图像自动分析流程
2.1 理论基础
PAS染色主要用于染色含有高比例碳水化合物(包括糖原)的结构3,比如用于小鼠肺哮喘模型的粘液分泌鉴别4。
本流程通过计数PAS切片中的相对PAS阳性颗粒总数和相对PAS阳性颗粒总面积,以实现客观的PAS切片自动分析。
2.2 流程和实例
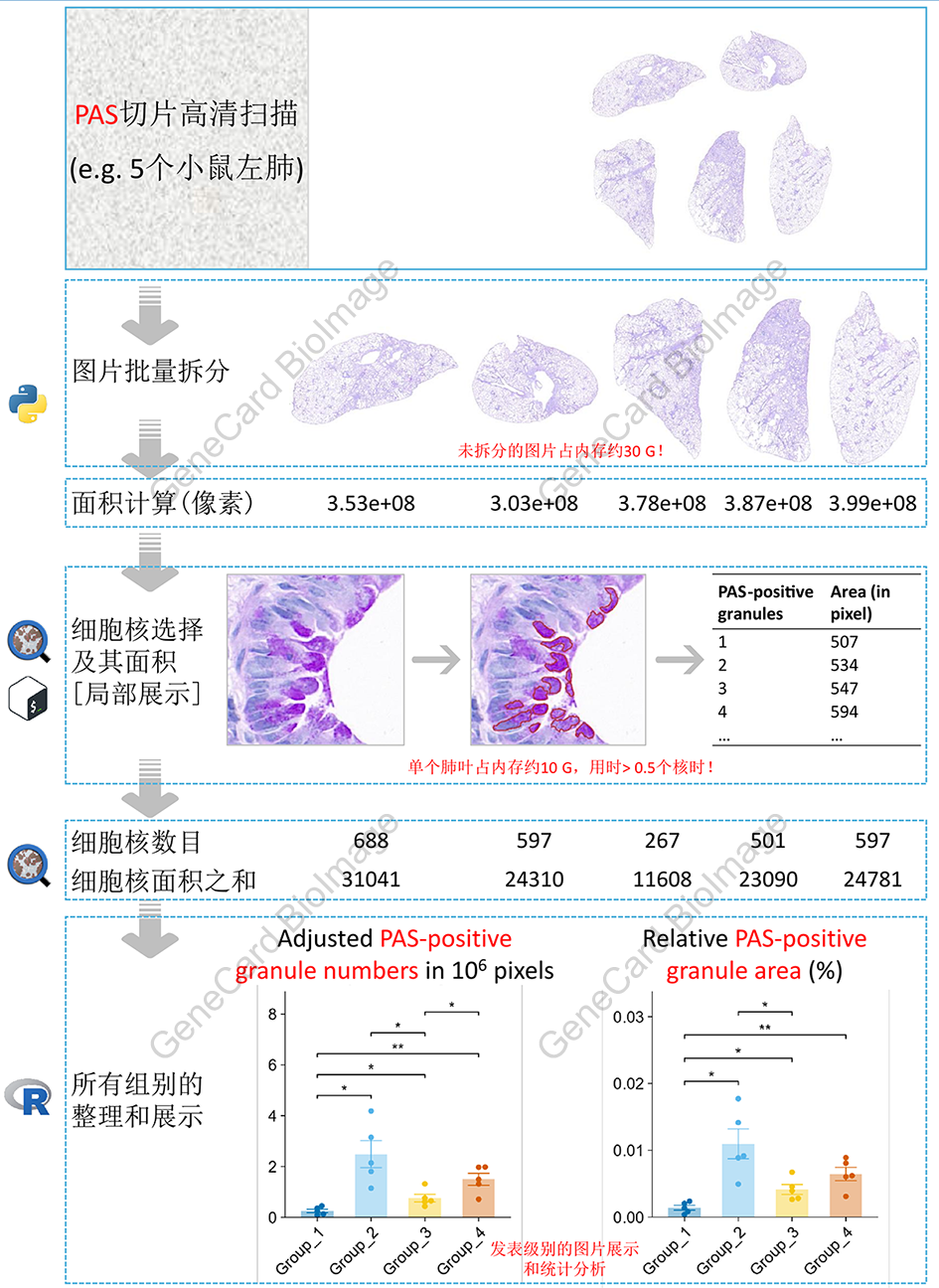
说明:示例所用组织切片使用3DHISTECH公司出品的Pannoramic 250 FLASH数字病理切片扫描仪进行扫描,采用20×明场物镜,获得全幅高分辨率数字图像,并保存为.mrxs格式以供分析。本示例切片的.mrxs格式文件大小约600 M。
3. 客观的免疫荧光图像自动分析流程
3.1 理论基础
免疫荧光(IF)是一种重要的免疫化学技术,能够在不同类型的组织和各种细胞制备中检测和定位多种抗原5,比如用于分析胞内菌和宿主细胞互作6、用于肿瘤的免疫治疗7等。
本流程通过无差别的选择视野(图片)中的所有胞内菌,并进行特定光通路对应区域的信号强度分析、及共定位分析,以实现客观的免疫荧光图像自动分析。
3.2 流程和实例
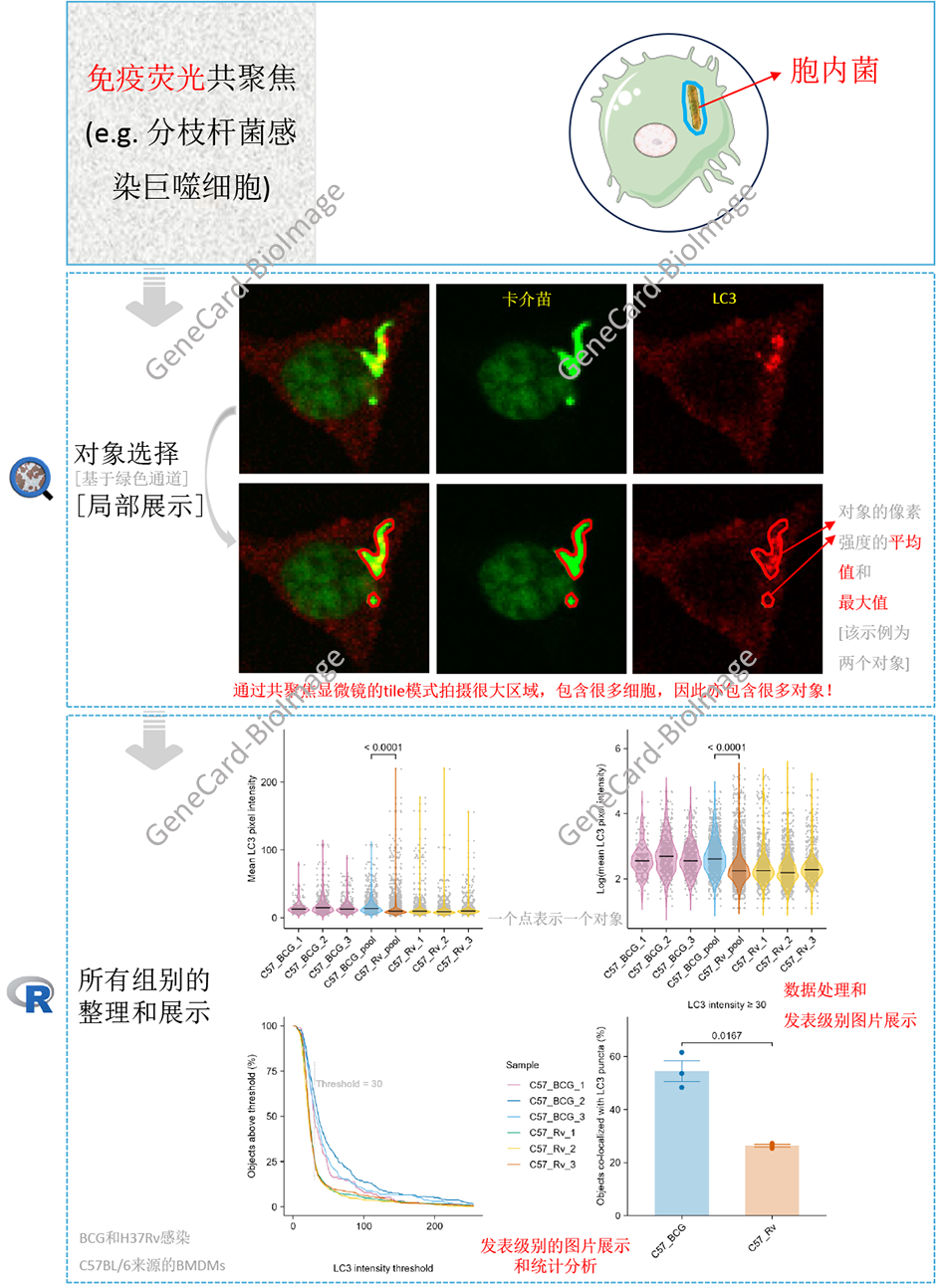
说明:示例所用共聚焦图片通过莱卡共聚焦显微镜获得,采用40×物镜,图片保存格式为tif。
4. 多重免疫荧光/空间蛋白组学细胞距离分析流程
4.1 理论基础
多重免疫荧光/空间蛋白组学染色可以用于分析蛋白的空间表达、定位、相互作用,及细胞的空间分布、相互作用等8。举例来说,Franken等通过含62个抗体组合(Akoya Biosciences,美国)的空间蛋白组学比较分析了头颈部鳞状细胞癌患者接受anti-PD-L1+anti-CTLA4或anti-PD-L1治疗后的肿瘤微环境的细胞差异和细胞相互作用差异9。
本流程通过无差别的选择全片(图片)中的所有细胞、并进行细胞类型鉴别和细胞定位,以实现客观的多重免疫荧光/空间蛋白组学细胞距离分析。
4.2 流程和实例
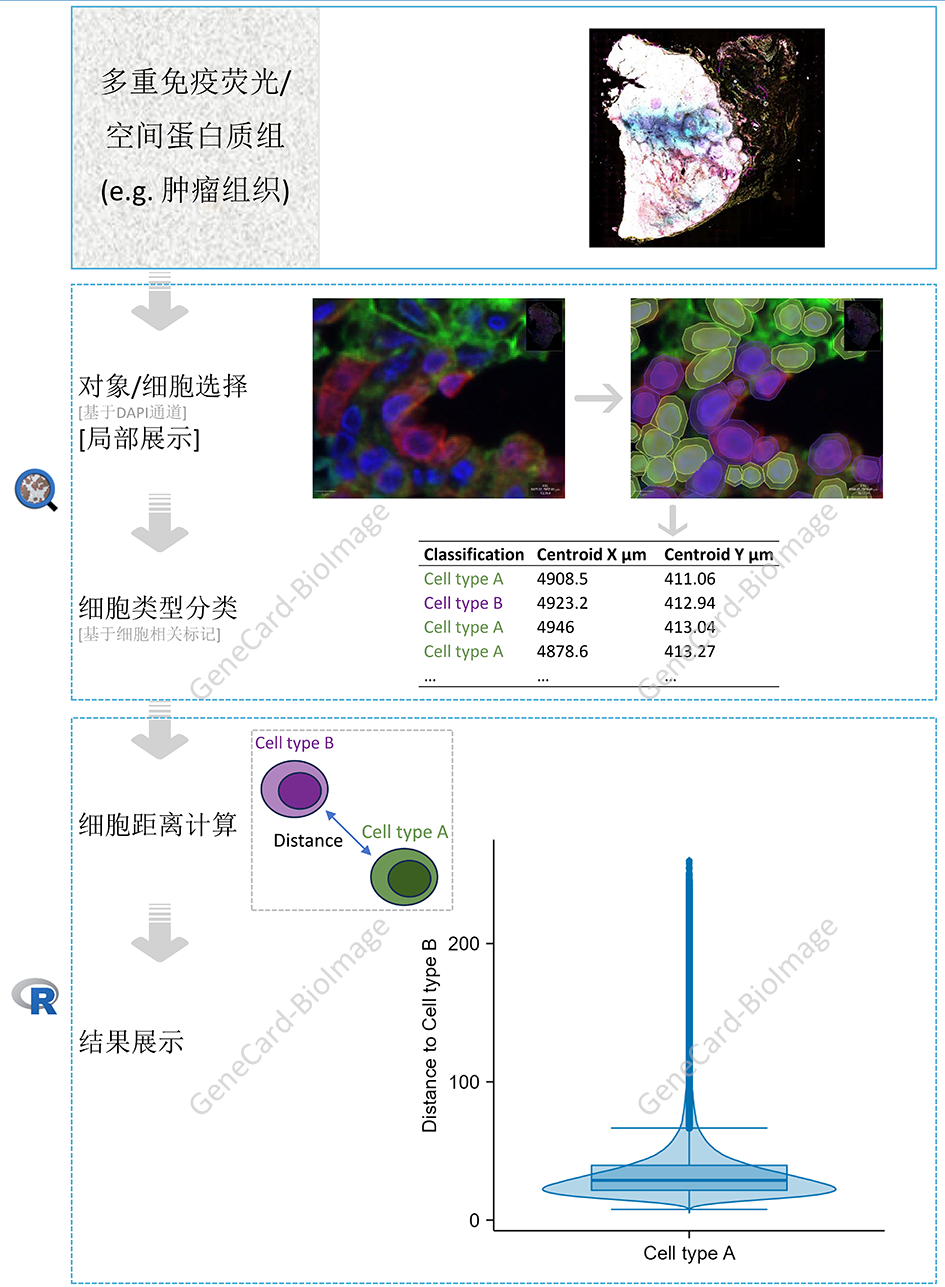
说明:该流程参考自10.
5. 电泳条带强度值分析流程
5.1 理论基础
核酸和蛋白的电泳是生物学中常用的分析方法。通过对电泳胶上条带的强度值进行分析,可以定量比较不同条带的(相对)表达水平。
5.2 流程和实例
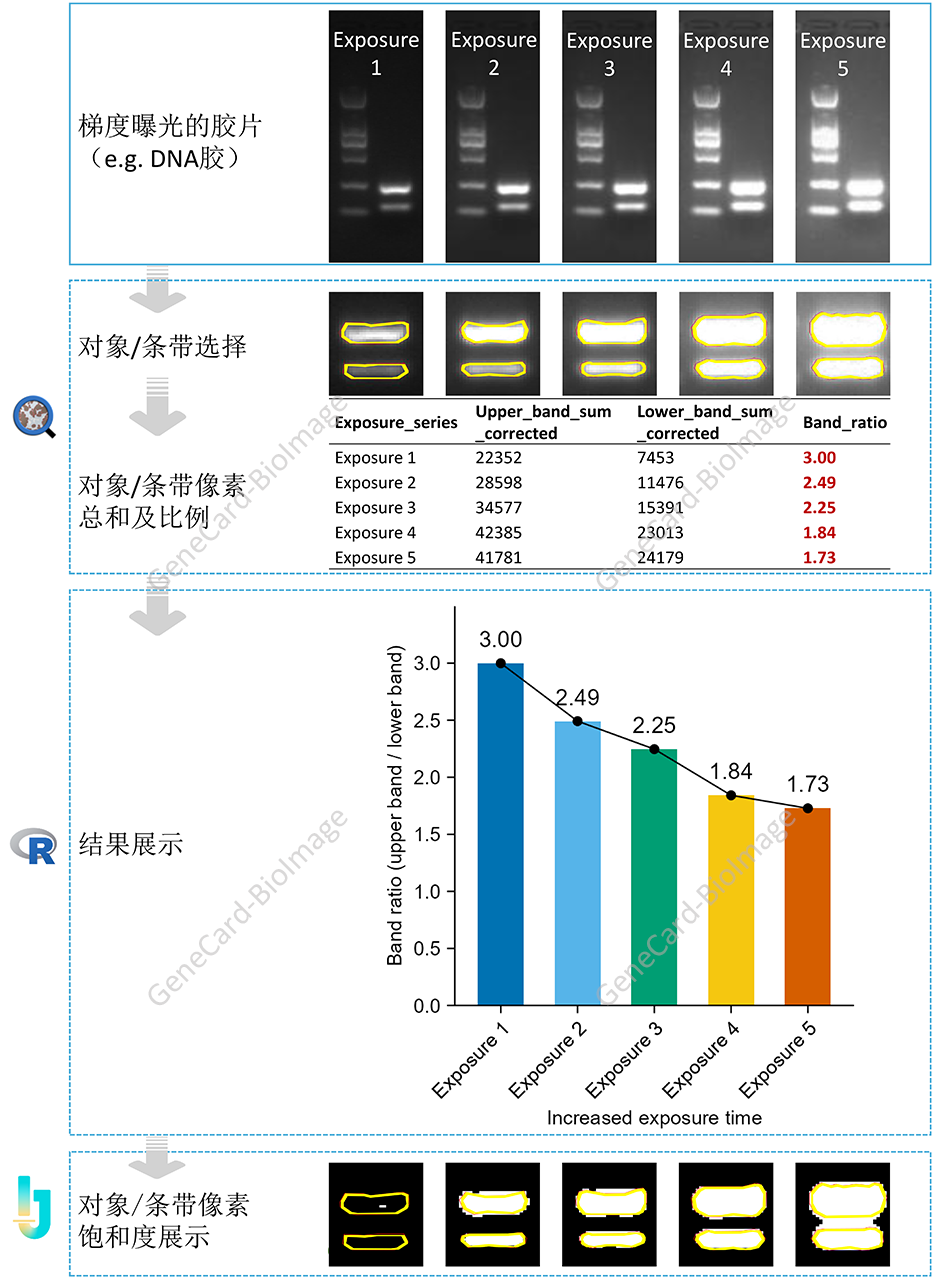
说明:示例以DNA电泳胶图片为例(同一胶的不同曝光时间的成像)。该实例亦说明,尽量就同一张胶采用系列的曝光时间成像,并从中选择合适的曝光时间进行分析,可以有效避免因曝光过度(像素强度饱和)而导致的结果偏差。
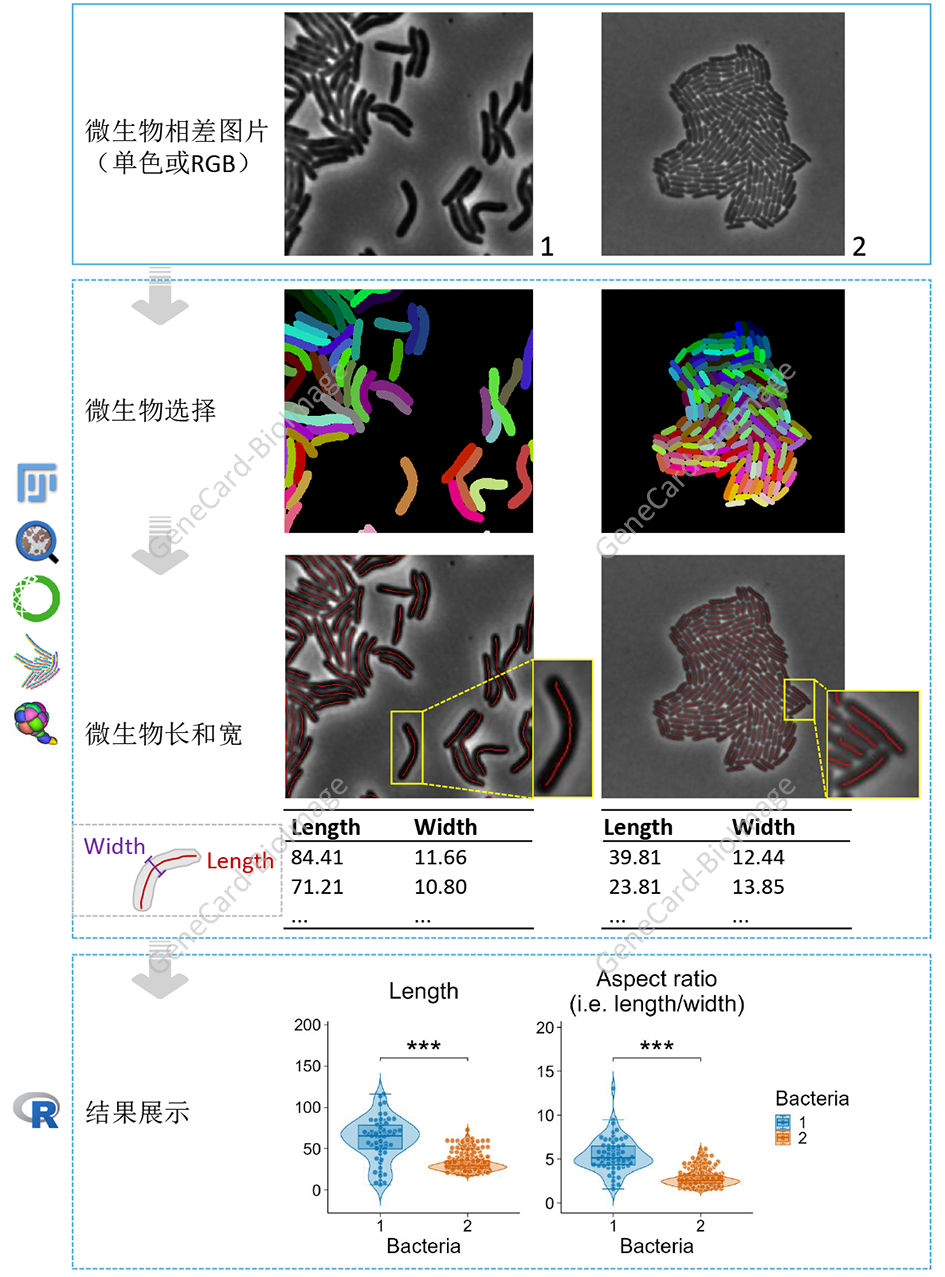
6. 细菌长度和宽度测量分析流程
6.1 理论基础
6.2 流程和实例
7. 胞内亮点测量
7.1 理论基础
针对感兴趣分子(比如转录本15、蛋白16、或其它分子)的(免疫)染色研究会在样本中检出很多亮点或斑点。这些亮点就是所感兴趣的分子。对这些亮点的选择和定量对解释科学问题至关重要。
7.2 流程和实例
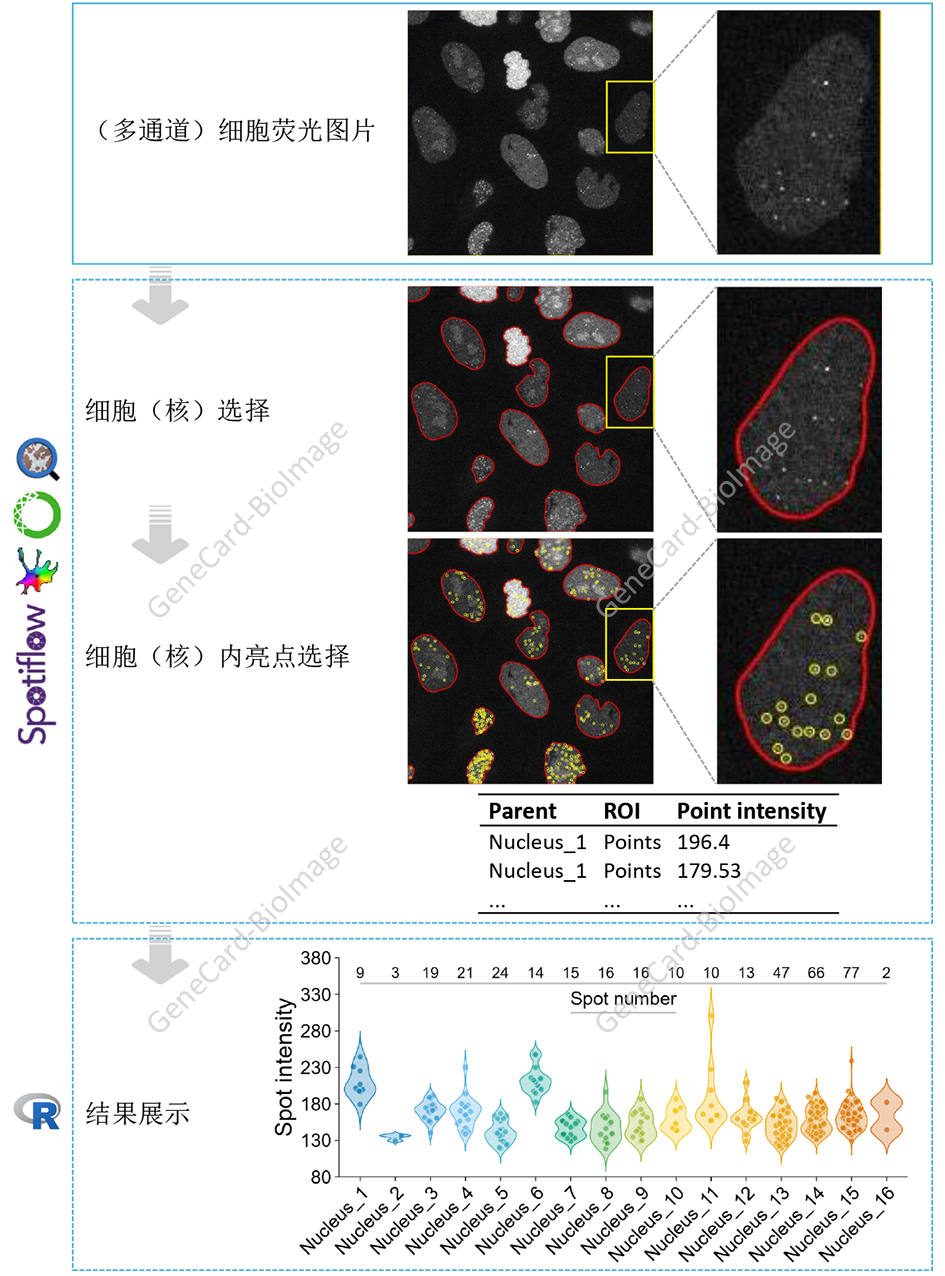
说明:示例图片来自Spotiflow17。